近日,药学院王磊/尤启冬团队在靶向分子伴侣系统复杂蛋白互作的小分子药物设计方向取得进展,相关成果发表于权威期刊Angewandte Chemie International Edition(IF:16.6)和学科顶尖期刊Journal of Medicinal Chemistry(IF:6.9)。
分子伴侣系统在维持蛋白稳态中扮演着重要角色,负责调控众多底物蛋白的成熟折叠与翻译后修饰。其中HSP90-CDC37-PP5-Kinase互作体系调节蛋白激酶成熟,并且在肿瘤发展进程中发挥重要作用。如何实现该复杂体系的精细化调控以获得适宜的治疗窗口是困扰学界已久的药物设计难题。CDC37是重要的共伴侣蛋白,在肿瘤细胞中特异性高表达,负责识别蛋白激酶并稳定其部分折叠构象,最终交由HSP90完成激酶的折叠成熟,是潜在的药物靶标。然而,CDC37蛋白表面缺乏经典药物口袋,小分子设计困难。
近日,王磊/尤启冬团队、上海交通大学医学院的张健教授、恒瑞医药全球研发总裁张连山教授作为共同通讯作者在在Angew. Chem发表题为“Allosteric CDC37 inhibitor disrupts chaperone complex to block CDK4/6 maturation”的研究论文。该研究发现了首个靶向CDC37的小分子化合物DDO-6079,其以变构作用机理同时实现了对HSP90-CDC37和CDC37-CDK4/6复杂蛋白互作的协同抑制。此外,研究还阐明了DDO-6079逆转Palbociclib耐药的机制,结果表明DDO-6079通过抑制CDK4/6的成熟和降低CDK6蛋白的热稳定性,进而恢复CDK4/6抑制剂在耐药细胞中的敏感性。药学院2021级博士生张立晓、2020级博士生刘伟、上海交通大学医学院助理研究员郑振、药学院副教授张秋月、2021级硕士生何彦仪为本文共同第一作者。
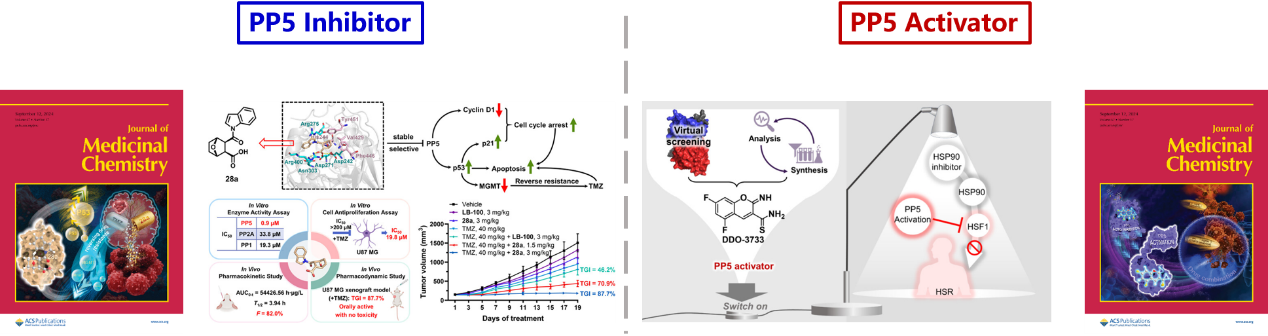
PP5也是一种重要的共伴侣蛋白,同时具有磷酸酶属性,负责调节底物蛋白的磷酸化状态,进而影响底物蛋白的活性、稳定性等重要特性。然而,目前对调控PP5的继发生物学效应研究尚不明确,致使靶向PP5药物应用受限。为此,王磊/尤启冬团队同时进行PP5抑制剂和激动剂开发,并先后在J. Med. Chem发表题为“Design and Synthesis of 7 Oxabicyclo[2.2.1]heptane-2,3-dicarboxylic Acid Derivatives as PP5 Inhibitors To Reverse Temozolomide Resistance in Glioblastoma Multiforme”和“Allosteric Activation of Protein Phosphatase 5 with Small Molecules”的研究论文,且均为当期封面文章。PP5抑制剂28a可诱导细胞周期阻滞和逆转TMZ耐药性;PP5激动剂DDO-3711的研究解决了因PP5自抑制状态产生的激动剂设计难题,还发现其与HSP90抑制剂联合使用在降低热休克蛋白毒性方面的潜在价值。两项研究探索了PP5调控效应及应用,为PP5的研究和应用提供了新的工具和思路。药学院王磊研究员和尤启冬教授为通讯作者,2021级博士生李泽坤、2022级硕士生郭沫辰和2023级硕士生顾明晓为抑制剂研究共同第一作者,药学院副教授张秋月、2021级硕士生颜玲和2021级博士生张立晓为激动剂研究共同第一作者。
以上工作获得了国家自然科学基金、江苏省自然科学基金、中国科协青年人才托举工程、中国博士后科学基金、中国药科大学兴药青创学者培育等项目的资助。
全文链接:
https://doi.org/10.1002/anie.202413618
https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c01304
https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c00722

示意图
示意图
(供稿单位:药学院,撰写人:刘华)


