近日,医学学科顶尖期刊Journal of Controlled Release在线发表了题为“Non-invasive co-delivery of Axitinib and telmisartan via LDH-based nanocarriers for synergistic VEGF/Ang-2 inhibition in ocular neovascular diseases”的最新研究成果。药学院药剂系博士研究生张萌、硕士研究生王玉美、汪嘉仪为本文共同第一作者,药学院操锋教授、工学院江峰副教授为本文的共同通讯作者,中国药科大学为本文唯一通讯单位。
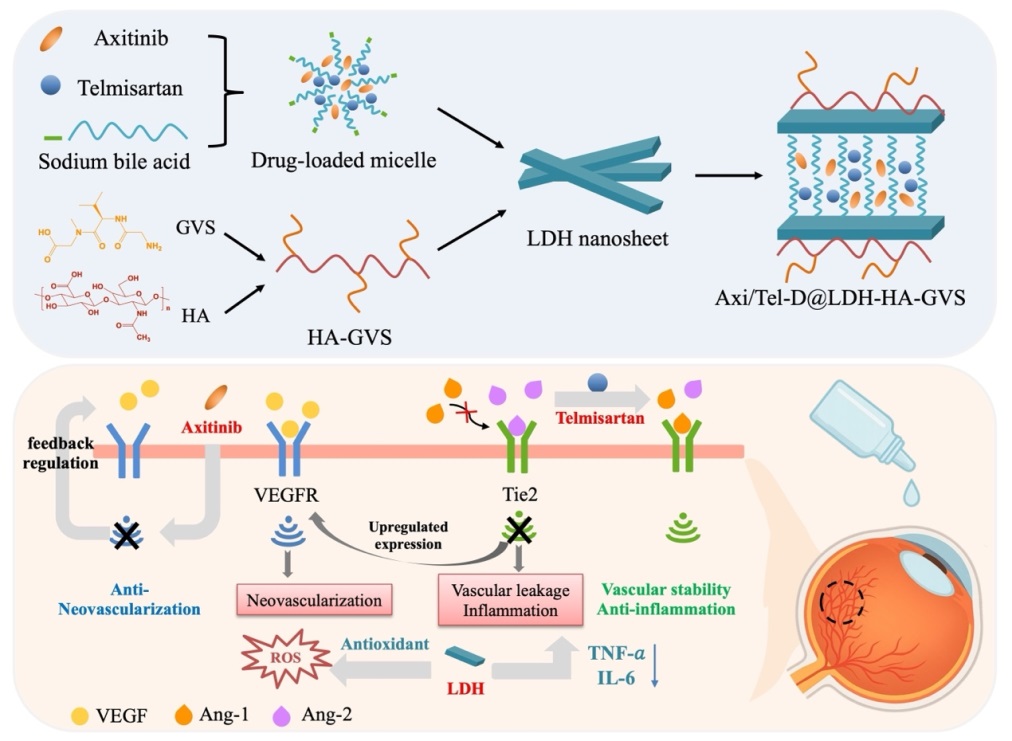
眼底新生血管性疾病(如湿性年龄相关性黄斑变性、糖尿病视网膜病变等)是全球不可逆视力损伤的主要原因,其核心病理特征为异常血管生成和血管渗漏。虽然抗VEGF玻璃体内注射已成为临床标准治疗手段,但该方式具有侵入性强、并发症风险高等局限,且部分患者对单一抗VEGF治疗反应存在耐药现象,提示多通路协同干预与无创给药策略的迫切需求。血管生成素-2(Ang-2)可通过破坏血管稳定性并协同VEGF信号,加剧病理性新生血管形成。基于此,本研究构建了一种基于层状双氢氧化物(LDH)的双药纳米递送系统,实现了VEGFR抑制剂阿西替尼(Axi)与Ang-2调控药物替米沙坦(Tel)的无创联合递送。针对两种药物水溶性差、难以直接插层进入LDH层间的难题,研究团队采用胶束辅助插层策略,实现了疏水小分子在LDH层间的有效插层与稳定负载。在此基础上,通过在LDH表面进一步修饰透明质酸(HA)-PepT1靶向三肽(GVS),赋予纳米载体良好的眼表黏附能力和组织渗透性能。
所构建的Axi/Tel-D@LDH-HA-GVS纳米复合体系能够实现阿西替尼与替米沙坦的缓慢释放,在眼表保持较长的滞留时间,并有效跨越眼部屏障递送至眼后段脉络膜-视网膜组织。体外研究表明,该纳米体系可被人结膜上皮细胞和视网膜色素上皮细胞高效摄取,在缺氧诱导的血管生成模型中显著抑制内皮细胞迁移及新生血管形成,并有效下调VEGF与Ang-2的表达水平。与此同时,含锌LDH纳米载体赋予体系抗炎和抗氧化生物活性。体内眼组织分布研究显示,该纳米体系显著提高了阿西替尼和替米沙坦的眼部生物利用度,实现了两种药物向眼后段组织的有效分布。在糖尿病视网膜病变动物模型中,该制剂可明显改善视网膜组织结构,并显著降低VEGF、Ang-2以及TNF-α、IL-6等血管生成和炎症相关因子的表达水平,展现出优异的协同治疗效果。综上,本研究构建了一种无创递送、兼具多通路协同抑制的多功能纳米递送体系,为眼底新生血管性疾病的无创药物递送与协同治疗提供了研究思路。
全文链接:https://doi.org/10.1016/j.jconrel.2025.114574
示意图
(供稿单位:药学院,撰写人:刘华)


