近日,中国药科大学药学院何玉立研究员、姚和权教授团队在国际权威期刊JOURNAL OF THE AMERICAN CHEMICAL SOCIETY在线发表研究论文,题为“Dynamic Kinetic Control Enables Nickel-Catalyzed Enantioconvergent C(sp3)–O Coupling”。药学院2023级博士研究生杜进泽为第一作者,药学院何玉立研究员和姚和权教授为共同通讯作者,中国药科大学为第一通讯单位。
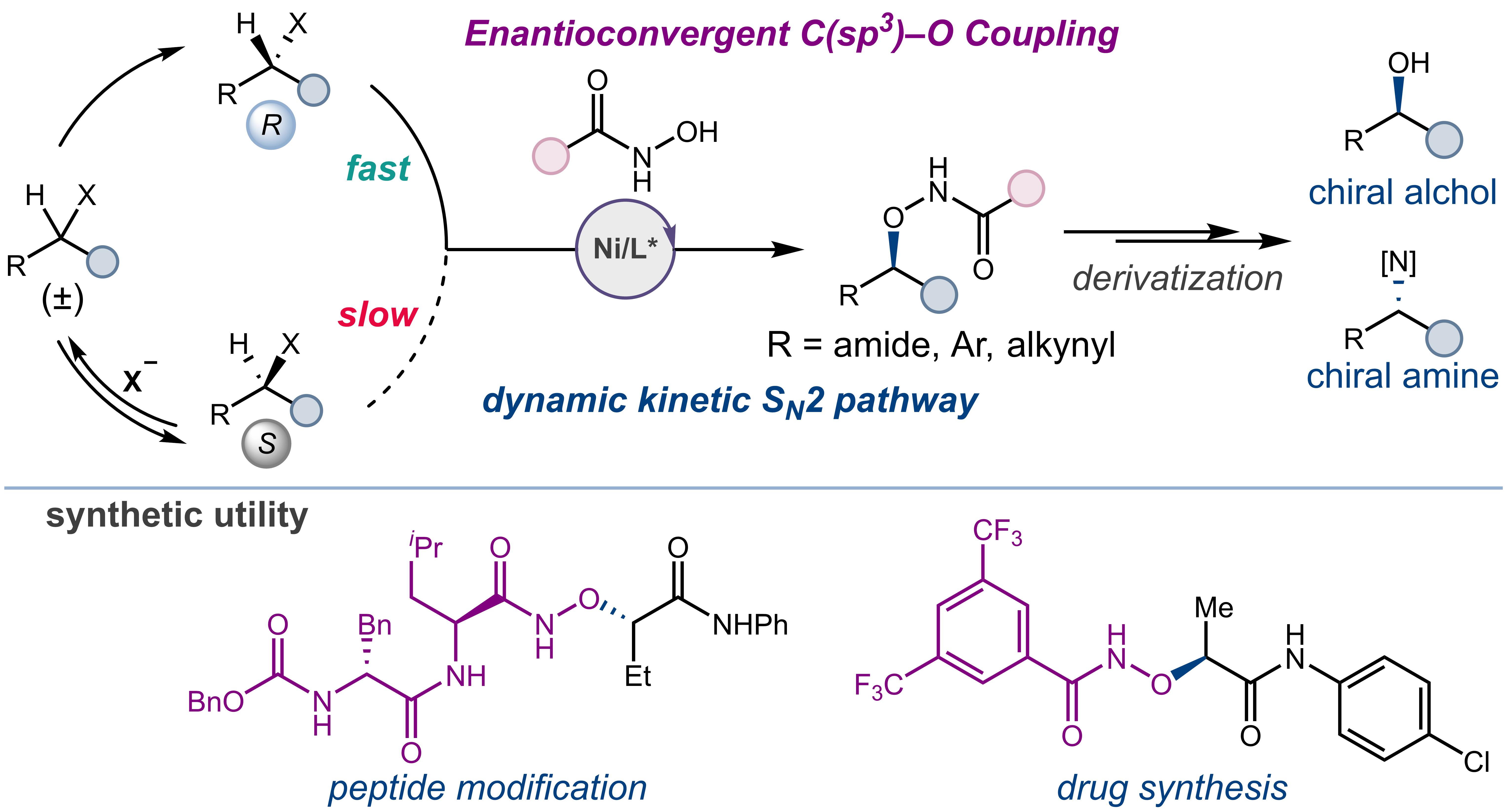
手性C(sp3)–O结构单元广泛存在于药物分子和天然产物中。据统计,2024年美国FDA批准的200个小分子药物中,约35%含有此类手性中心。然而,如何从廉价易得的外消旋烷基卤代物出发,直接、高效地构建高光学纯度的C(sp3)–O键,一直是不对称催化领域的长期挑战。传统方法如Williamson合成通常依赖于昂贵的手性起始原料,而现有的金属催化策略则多局限于烯丙基或炔丙基等π-活化底物。
针对这一难题,研究团队另辟蹊径,提出了一种创新性的解决思路:利用过渡金属催化剂选择性活化亲核试剂(而非亲电试剂),从而对简单的烷基卤代物发生直接的不对称亲核取代反应。为克服背景反应、催化剂失活及多种反应路径(SN2、SN1、自由基)并存等固有挑战,团队巧妙地将动态动力学拆分(DKR)原理引入该体系。其核心在于,利用反应过程中释放的卤素离子原位促进外消旋底物的快速消旋化,同时手性镍催化剂选择性地与其中一种对映体发生反应。这一设计无需额外的消旋催化剂或能量输入(如光、热),极大地简化了反应条件,并提高了原子经济性和官能团兼容性。
该催化体系条件温和、操作简便,可在空气和水分存在下稳定运行,适用于多类结构多样的外消旋α-卤代酰胺及苄基/烯丙基溴代物,并对芳香族和脂肪族羟肟酸均表现出优异适用性,普遍实现高收率和高对映选择性(最高达99% ee)。该方法兼具规模化可行性与实际应用价值,可以实现克级放大,并成功应用于Rho通路抑制剂(S)-CCG-1423及阿尔茨海默病候选药物γ-分泌酶抑制剂LY411575关键中间体的高效合成,充分彰显了其在药物研发与复杂分子后期修饰中的广阔应用前景。
该研究提出了一种不对称C(sp3)–O键构筑的全新通用策略,不仅显著拓展了不对称催化反应的研究边界,也为药物分子合成及复杂分子的后期官能化提供了有力工具,同时为过渡金属催化立体汇聚式交叉偶联反应开辟了新的机制路径和研究方向。
以上工作得到了国家自然科学基金面上项目(NSFC22371298,NFSC22371299)和多靶标天然药物全国重点实验室自主研究课题项目(SKLNMZZ202211)的资助。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.5c18000
示意图
(供稿单位:药学院,撰写人:刘华)


