近日,国际著名期刊Journal of the American Chemical Society(IF: 16.383)在线发表了我校药学院王磊/尤启冬团队题为“Protein phosphatase 5-recruiting chimeras for accelerating apoptosis signal-regulated kinase 1 dephosphorylation with antiproliferative activity”的最新研究成果。课题组博士后张秋月为本文的第一作者,王磊副教授、尤启冬教授、张连山教授为本论文的通讯作者,中国药科大学为本论文的第一通讯单位。
近年来,王磊/尤启冬团队围绕靶向分子伴侣系统复杂蛋白相互作用的小分子药物设计开展了大量研究工作,基于伴侣系统与底物识别机制提出了多种分子设计新策略并取得了多项重要研究成果(J.Med.Chem. 2022, 65, 8144-8168; J.Med.Chem. 2022, 65, 10809-10847; J.Med.Chem. 2022, 65, 8091-8112; J.Med.Chem. 2021, 64, 8916-8938; J.Med.Chem. 2020, 63,1281-1297; Acta. Pharm Sin. B. 2020, 10, 1904-1925; Sci Adv. 2019, 5, eaax2277)。
本研究在前期工作基础上,基于HSP90-CDC37-PP5-Kinases分子伴侣体系特点,设计小分子精确地调控底物蛋白的异常磷酸化。本研究以共伴侣蛋白PP5的磷酸酶功能为基础,通过将PP5和底物蛋白ASK1的小分子配体通过化学连接链相连,发现了PhoRCs磷酸酶募集嵌合体多特异性小分子DDO3711,可特异性将p-ASK1T838去磷酸化,解决了胃癌细胞中因 ASK1的过度磷酸化而导致的细胞异常增殖问题。DDO3711能够以直接结合并拉近 ASK1和 PP5的方式来促进p-ASK1T838的去磷酸化调控,进而抑制ASK1下游信号通路JNK、p-38的激活以及细胞周期相关蛋白CDK4/6、cyclin D1的表达,最终实现了显著的抗胃癌细胞增殖效果。以上研究充分利用了共伴侣蛋白PP5的磷酸酶功能,巧妙地设计小分子调控剂将其与过度磷酸化的底物蛋白相连,在不影响底物蛋白表达的同时,实现了对其磷酸化过程的精准调控,为小分子调控蛋白的翻译后修饰过程提供了重要研究思路与范例。
该工作获得了国家自然科学基金重点项目、面上项目、青年项目(82173741, 82003582, 81930100),江苏省自然科学基金青年项目(BK20190559)以及中国科协青年人才托举工程项目(2021QNRC001)的资助。
原文链接: https://doi.org/10.1021/jacs.2c10759
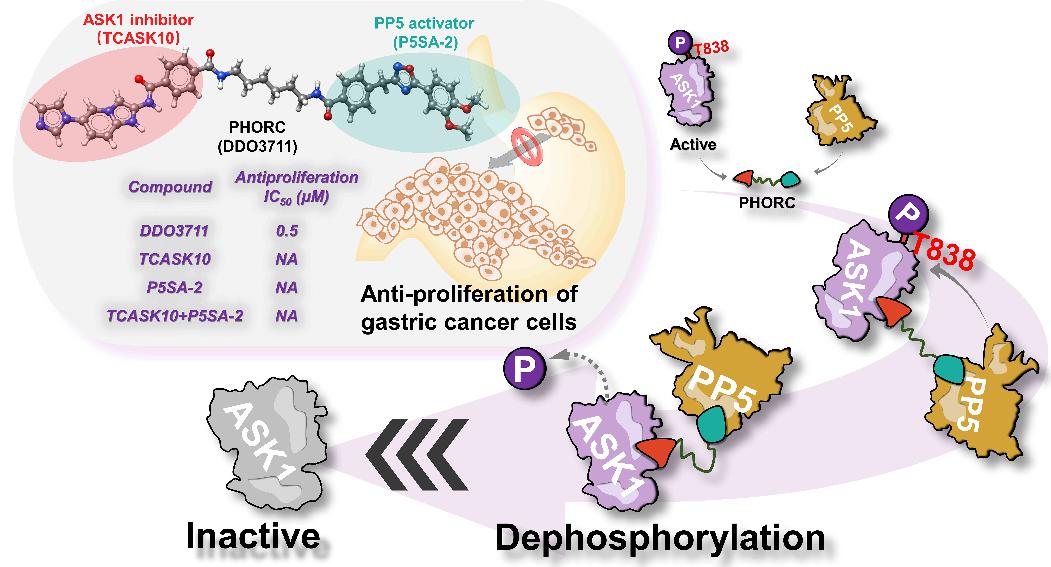
分子设计原理示意图


